記憶・学習をささえる脳内D-アミノ酸の機能
掛川 渉
私たちの生命活動を担うアミノ酸は、タンパク質の構成成分としてだけでなく、細胞内や血液、そして組織液中に遊離し、さまざまな生化学反応に寄与する重要な分子である。アミノ酸には構造の違いからL体とD体とが存在し、私たちを含む多くの生命体はおもにL-アミノ酸によって構成されている。しかし、近年になって、たくさんの種類のD-アミノ酸が生体内で検出されるようになってきた。とりわけ、D-アミノ酸のひとつであるD-セリンが脳や脊髄などの中枢神経系に豊富に存在することが確認されて以来、記憶や学習をはじめとする高次脳機能へのD-アミノ酸の関与が注目されている1)。そこで本稿では、著者らが見出した、記憶・学習をささえる新しい脳内D-アミノ酸シグナリングについて紹介したい。
図1 私たちの脳
シナプス可塑性は、脳内のあらゆる領域において普遍的に起こる現象であるが、興味深いことに、D-セリンはこのシナプス可塑性の誘導に深く関与している。げっ歯類の脳を用いた実験では、D-セリンは海馬や大脳皮質を含む多くの領域で恒常的に存在している。これまで、D-セリンは、iGluRメンバーであるNMDA型グルタミン酸受容体 (以下、NMDA受容体と略す) のコアゴニストとして作用し、共役するイオンチャネルを介したカルシウム流入を引き金に、シナプス表面のAMPA受容体数を調節し、シナプス可塑性や記憶・学習を制御することが明らかにされてきた (図2左)4)。
また、協調運動や運動記憶・学習を担う小脳では、生後発達期という限られた期間にのみD-セリンが検出される5)。最近、X線結晶解析法を用いた構造学的研究により、D-セリンがNMDA受容体ばかりでなく、他のiGluRメンバーであるデルタ2型グルタミン酸受容体 (以下、デルタ2受容体と略す) の細胞外領域にも結合することが報告された (図2右)6)。デルタ2受容体は小脳神経回路の要衝を担う顆粒細胞軸索平行線維 (parallel fiber; PF)-プルキンエ細胞間シナプス (PFシナプス) にほぼ選択的に発現し、PFシナプスで観察されるLTDや小脳依存性の運動記憶・学習を調節する重要な分子であることが、デルタ2受容体発現を欠く遺伝子欠損マウス (デルタ2欠損マウス) の解析から明らかにされている7)。しかし奇妙なことに、デルタ2受容体はiGluRメンバーであるにもかかわらず、in vitro系では、D-セリンを含む一般的なiGluR作用薬に対してまったくチャネル応答を示さない。そのため、脳内のデルタ2受容体がどのように機能しているのかは長らく不明であった。加えて、発達期小脳に豊富に存在するD-セリンがデルタ2受容体に結合する生理的意義についてもまったく分かっていなかった。そこで著者らは、D-セリンとの結合能を失った変異デルタ2受容体をデルタ2欠損プルキンエ細胞に発現させた“レスキュー”マウス (変異型レスキューマウス) を作製し8)、上記課題を追究することにした。
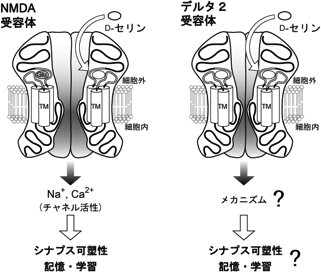
図2 脳内に発現するD-セリン受容体
はじめに、デルタ2受容体へのD-セリン結合がPFシナプスの伝達機能を制御しうるかを、マウス小脳急性切片を用いた電気生理学実験により検討した (図3)。PFを電気刺激することにより誘発されるシナプス応答をパッチクランプ法によりプルキンエ細胞から記録すると、AMPA受容体を介する速い興奮性シナプス後電流 (PF-evoked excitatory postsynaptic current; PF-EPSC) が観察される (図3A)。このPF-EPSCの振幅が安定した後、D-セリン (200 μM, 10 分間) を細胞外投与すると、野生型デルタ2受容体を発現する正常型レスキューマウスでは、PF-EPSCが徐々に減少し (rundown)、D-セリン除去後も尚、その大きさが維持された (図3B)。また、この現象は、AMPA受容体のエンドサイトーシスを阻害する薬剤でほぼ完全に抑制された。それに対して、変異型レスキューマウスからのPF-EPSC記録では、D-セリン投与によるrundownは認められなかった。すわなち、D-セリンはデルタ2受容体に結合することでシナプス表面のAMPA受容体のエンドサイトーシスをもたらすことが示唆された9)。
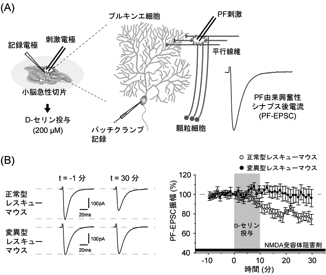
図3 D-セリン依存性PF-EPSC rundown。D-セリン-デルタ2受容体シグナリングの関与を直接評価するため、NMDA受容体阻害剤存在下で実験を行った。
次に、生後発達期小脳に豊富に存在するD-セリンが神経活動にともなって細胞外へ放出されうるかを2次元高速液体クロマトグラフィー (2D-HPLC) 法10)により検討した (図4)。生後発達期および成熟期のマウスから小脳急性切片を作製し、人工脳脊髄液中において小脳切片の神経活動を上昇させるような刺激 (PFの電気刺激や薬剤刺激)を与えると、生後発達期標本において細胞外へのD-セリンの放出が観察された。一方、成熟期標本では同様な刺激を与えてもD-セリンの放出は認められなかった。続いて、D-セリンが脳内のどの細胞から放出されているかを確かめることにした。脳内には神経回路を構築する神経細胞に加えて、その数をはるかに超える数のグリア細胞と呼ばれる細胞が存在する。これまで海馬や大脳皮質標本を用いた実験では、D-セリンはグリア細胞から放出されることが示されている4)。そこで、生後発達期小脳切片をグリア細胞選択的な代謝阻害剤 (NaFAC) で処理すると、D-セリンの放出は著しく抑えられた。また、グリア細胞に発現するiGluRの選択的阻害剤 (NASP) で処理した標本や、小胞性放出機構を阻害するテタヌス毒素をアデノウィルスベクターによりグリア細胞に発現させた標本では、神経活動依存的なD-セリン放出が有意に抑制された。以上の結果から、生後発達期小脳において、D-セリンは神経活動依存的にグリア細胞から放出されることが分かった9)。
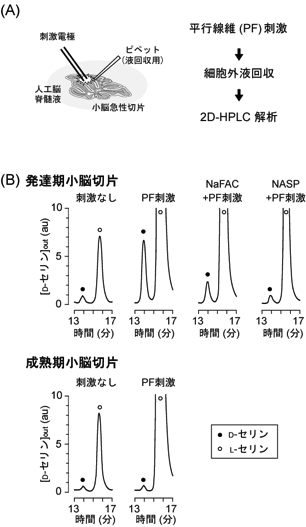
図4 2D-HPLC法による細胞外D-セリン検出。(A) 実験手順。(B) 各条件下におけるD-セリン (黒丸) およびL-セリン (白丸) シグナル。
では、神経活動依存的に放出されるD-セリンは、PFシナプスの伝達機能を制御し、シナプス可塑性の誘導に影響を与えうるのであろうか?このことを確かめるために、生後発達期小脳切片のプルキンエ細胞よりLTD記録を行った。野生型マウス小脳切片のPFにLTD誘導刺激を与えると、大きなLTDが観察される。しかし、小脳切片をD-アミノ酸分解酵素 (DAO) により処理したのち小脳LTD記録を行うと、LTDが完全に阻害された (図5A)。すなわち、この結果は、小脳におけるLTD誘発にD-セリンが必要であることを示唆する。
次に、小脳LTDを制御するD-セリンの作用点がデルタ2受容体である可能性を検証するため、デルタ2レスキューマウスを用いることにした。その結果、正常型レスキューマウスではLTDが認められたのに対し、変異型レスキューマウスではLTDが有意に抑制されていた (図5B)。したがって、生後発達期小脳におけるLTDはD-セリン→デルタ2受容体シグナリングを介して調節されることが確認できた9)。
それでは、D-セリンに結合したデルタ2受容体はどのような活性化様式を伴って小脳LTDを調節するのであろうか?前述のとおり、デルタ2受容体はiGluRメンバーであることから、“脳内”ではイオンチャネルとして機能しているかもしれない。この疑問に答えるため、デルタ2受容体のアミノ酸配列に保存されている推定上のチャネルポア部位に点変異を加えてチャネル機能を失わせた変異型受容体 (チャネルポア (×)) を11)、シンドビスウイルスベクターを用いてデルタ2欠損マウスのプルキンエ細胞に導入した。すると、驚くべきことに、デルタ2欠損マウスで障害されていた小脳LTDがほぼ完全に回復した (図5C)。また、デルタ2受容体の細胞内最C末端領域7残基を欠失させた変異型受容体 (最C末端領域 (×)) を12)、デルタ2欠損マウスに導入してLTD記録を行うと、十分量の受容体が発現しているにもかかわらず、LTD障害の回復はほとんど認められなかった (図5C)。以上の結果から、生後発達期小脳に存在するD-セリンは、デルタ2受容体と結合することにより、最C末端領域を介した細胞内シグナル伝達系を駆動させ、シナプス表面のAMPA受容体数を調節することで、小脳LTDを制御していることが示唆された9)。iGluRメンバーであるデルタ2受容体が、チャネル活動に非依存的に働いていることはきわめて興味深い。
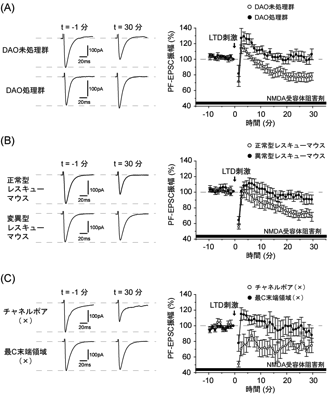
図5 2D-セリン依存性小脳LTD記録。D-セリン-デルタ2受容体シグナリングの関与を直接評価するため、NMDA受容体阻害剤存在下で実験を行った。
最後に、デルタ2受容体へのD-セリン結合が運動記憶・学習に影響を与えるかどうかを、マウスの運動記憶・学習能を評価しうるローターロッド試験を用いて調べた。正常型レスキューマウスと変異型レスキューマウスとのあいだで成績を比較したところ、変異型レスキューマウスは正常型レスキューマウスに比べ、生後発達期での学習成績が低下していることが分かった。また、連日にわたり試験をくり返すと、変異型レスキューマウスにおいては前日までに得られた成績が次の日まで維持されない、すなわち、効率よく記憶されていないことも示された (図6)。以上の結果は、D-セリンによるデルタ2受容体の活性制御がマウスの運動記憶・学習を調節しうることを強く示唆する9)。
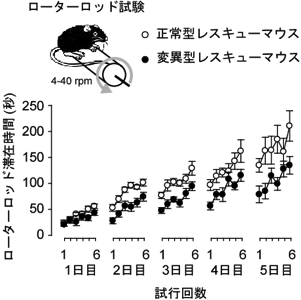
図6 ローターロッド試験を用いたデルタ2レスキューマウスの行動実験
今回、著者らは、D-セリンがデルタ2受容体の内在性のリガンドとして作用し、シナプス可塑性や運動記憶・学習を制御することを報告した。この生後発達期小脳で働くD-セリン→デルタ2受容体シグナリングの生理的意義については、依然として想像の域を越えないが、おそらく、この新規D-セリンシグナリングは、自然界で生まれた動物が厳しい生活環境を生きぬくうえで必要な運動能力や運動技能を、逸早く身につけるために使われてきたのかもしれない。
近年、D-セリンはデルタ2受容体だけでなく、その同族分子であるデルタ1受容体にも結合しうることが分かってきた13)。デルタ1受容体は、胎生期から成熟期にかけて脳全域に広く発現し14)、デルタ1受容体発現を欠く遺伝子欠損マウスでは、作業記憶や恐怖条件付け学習など、いくつかの記憶・学習パラダイムに障害を呈すことが報告されている15)。そのため、D-セリン→デルタ1受容体シグナリングが、各脳領域で観察されるシナプス可塑性を調節し、種々の記憶・学習過程に関与している可能性も考えられる。今後、D-セリン→デルタ受容体シグナリングの解明が、記憶・学習形成の分子レベルでの理解に繋がることを期待している。
1. Hashimoto A, Oka T. 1997. Free d-aspartate and d-serine in the mammalian brain and periphery. Prog Neurobiol 52:325-353.
2. Chen C, Tonegawa S. 1997. Molecular genetic analysis of synaptic plasticity, activity-dependent neural development, learning, and memory in the mammalian brain. Ann Rev Neurosci 20:157-184.
3. Yuzaki M. 2013. Cerebellar LTD vs. motor learning-lessons learned from studying GluD2. Neural Networks 47:36-41.
4. Oliet SH, Mothet JP. 2009. Regulation of N-methyl-d-aspartate receptors by astrocytic d-serine. Neuroscience 158:275-283.
5. Schell MJ, Brady RO Jr, Molliver ME, Snyder SH. 1997. d-Serine as a neuromodulator: regional and developmental localizations in rat brain glia resemble NMDA receptors. J Neurosci 17:1604-1615.
6. Naur P, et al. 2007. Ionotropic glutamate-like receptor d2 binds d-serine and glycine. Proc Natl Acad Sci USA 104:14116-14121.
7. Kashiwabuchi N, et al. 1995. Impairment of motor coordination, Purkinje cell synapse formation, and cerebellar long-term depression in GluRd2 mutant mice. Cell 81:245-252.
8. Hirai H, et al. 2005. Rescue of abnormal phenotypes of the d2 glutamate receptor-null mice by mutant d2 transgenes. EMBO Rep 6:90-95.
9. Kakegawa W, et al. 2011. d-Serine regulates cerebellar LTD and motor coordination through the d2 glutamate receptor. Nat Neurosci 14:603-611.
10. Miyoshi Y, et al. 2009. Determination of d-serine and d-alanine in the tissues and physiological fluids of mice with various d-amino-acid oxidase activities using two-dimensional high-performance liquid chromatography with fluorescence detection. J Chromatogr B Analyt Technol Biomed Life Sci 877:2506-2512.
11. Kakegawa W, Kohda K, Yuzaki M. 2007. The d2 ‘ionotropic’ glutamate receptor functions as a non-ionotropic receptor to control cerebellar synaptic plasticity. J Physiol 584:89-96.
12. Kakegawa W, et al. 2008. Differential regulation of synaptic plasticity and cerebellar motor learning by the C-terminal PDZ-binding motif of GluRd2. J Neurosci 28:1460-1468.
13. Yadav R, Rimerman R, Scofield MA, Dravid SM. 2011. Mutations in the transmembrane domain M3 generate spontaneously open orphan glutamate d1 receptor. Brain Res 1382:1-8.
14. Konno K, et al. 2014. Enriched expression of GluD1 in higher brain regions and its involvement in parallel fiber-interneuron synapse formation in the cerebellum. J Neurosci 34:7412-7424.
15. Yadav R, et al. 2013. Deletion of glutamate d-1 receptor in mouse leads to enhanced working memory and deficit in fear conditioning. PLoS One 8:e60785.

掛川 渉(かけがわ わたる)氏
略 歴
1993-1997 群馬大学工学部材料工学科
1997-1999 群馬大学大学院工学系研究科修士課程
1999-2003 群馬大学大学院医学系研究科博士課程
2002-2004 日本学術振興会特別研究員
2003 St. Jude Children’s Research Hospital博士研究員
2004-2011 慶應義塾大学医学部生理学助手 (2007より助教)
2011-現在 慶應義塾大学医学部生理学専任講師