哺乳類における遊離型D-アスパラギン酸の生化学
片根 真澄
ヒトを含めた哺乳類体内には、主な遊離型D-アミノ酸としてD-セリン(D-Ser)とD-アスパラギン酸(D-Asp)が見出される。近年、研究が著しく進展したD-Serとは対照的に、D-Aspについては研究が大きく立ち遅れている。1986年にDunlopらにより、遊離型のD-Aspがヒトを含めた哺乳類体内に存在することが初めて報告された 1)。それ以来、D-Aspは脳、網膜、松果体、下垂体、副腎および精巣といった様々な組織に多量に存在することが確認され、それらの組織におけるD-Aspの局在性や個体の成長に伴った含量の変化などが詳細に調べられてきた。哺乳類のD-Aspについては、主に神経内分泌系および内分泌系組織において種々のホルモンやステロイドの産生・分泌の調節といった重要な生理活性を示すことが知られている(表1)。また、D-Serがイオンチャネル型L-グルタミン酸(L-Glu)受容体の一種であるN-メチル-D-Asp(N-methyl-D-Asp;NMDA)受容体にコアゴニストとして結合して作用するのに対し、D-AspはNMDA受容体のL-Glu結合部位にアゴニストとして結合し、この受容体を活性化することが報告されている 2–4)。このように、D-Aspは重要な生理活性物質として機能していることが示唆されているが、その生理的役割の詳細は未だ不明である。
D-Aspの代謝(合成と分解)や動態(細胞内への取り込みと細胞外への放出)を解析することは、その生理的役割を明らかにするうえで重要なことと考えられる。著者らはこれまでに、D-Aspの代謝関連酵素の同定・機能解析を行ってきた 5–10)。また、D-Aspの細胞外への放出機構についても解析してきた 11–13)。本稿では、D-Aspの代謝に関する著者らの最近の研究結果をまとめた。D-Aspの動態や機能の詳細に関しては、他の総説を参照されたい 14–16)。
表1 哺乳類の神経内分泌系および内分泌系組織におけるD-Aspの生理活性
組織 |
標的細胞 |
生理活性 |
松果体 |
実質細胞 |
メラトニン合成・分泌の抑制 |
下垂体前葉 |
プロラクチン産生細胞 |
プロラクチン分泌の促進 |
下垂体中葉 |
a-メラニン細胞刺激ホルモン産生細胞 |
プロオピオメラノコルチンの産生調節 |
下垂体後葉 |
巨大神経分泌ニューロン |
オキシトシン・バソプレッシンの産生調節 |
精巣 |
ライディッヒ細胞 |
テストステロン産生の亢進 |
このように、哺乳類におけるD-Aspの合成経路は未だ不明であるが、最近、機能未知のタンパク質であったマウスglutamate-oxaloacetate transaminase 1-like 1(GOT1L1)がPLP依存的にAspラセマーゼ活性を示すと報告された 26)。興味深いことに、アカガイとアメフラシのAspラセマーゼが哺乳類のSerラセマーゼ(D, L-Serの相互変換を触媒するD-Serの合成酵素)と比較的高いアミノ酸配列相同性を示すのに対し、マウスGOT1L1は哺乳類のSerラセマーゼよりもL-Aspアミノトランスフェラーゼに高い相同性を示す。また、マウスGOT1L1が404アミノ酸残基から成るのに対し、ラットおよびヒトGOT1L1はそれぞれ315および421アミノ酸から成り、これら3種のタンパク質間ではアミノ酸残基数の保存性が比較的低いことも明らかであった。したがって、GOT1L1がD-Aspの主要な合成酵素であることには疑問の余地があると考えられた。
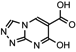
そこで著者らは、種々の哺乳類培養細胞株を用いて、ラットおよびヒトGOT1L1がD-Aspの生合成能を有するか否かを解析した。まず始めに、種々のラットおよびヒト由来培養細胞株を用いて、細胞内D-Asp含量とGOT1L1 mRNAの発現レベルとの相関を解析した。この際、D-Aspの分解酵素であるD-Aspオキシダーゼ(D-Asp oxidase;DDO)mRNAの発現レベルも同時に解析した。その結果、DDOの発現レベルを考慮したとしても、GOT1L1の発現レベルと細胞内D-Asp含量との間に明確な相関性は得られないことが明らかになった 24)。次に、D-Aspを生合成しているラット下垂体腫瘍由来GH3細胞を用いて、Got1l1遺伝子のノックダウンがD-Aspの生合成に与える影響を解析したところ、ノックダウンによる培養系全体のD-Asp含量の低下は認められなかった(図1)。したがって、ラットおよびヒト細胞では、D-Aspの生合成にGOT1L1はほとんど寄与していないと考えられる。
最近、Tanaka-HayashiらによりGOT1L1のノックアウトマウスの作成とその解析結果が報告された 27)。野生型およびノックアウトマウス間で、海馬および精巣におけるD-AspおよびL-Asp含量に有意な変化は認められない。また、哺乳類培養細胞株で発現させた組換えGOT1L1が、L-AspからD-Aspを生成するAspラセマーゼ活性は示さない一方で、L-Aspアミノトランスフェラーゼ活性を示すと報告されている 27)。すなわち、哺乳類におけるD-Asp合成経路の詳細は、依然として不明であるというのが現状である。
興味深いことに、アカガイのAspラセマーゼがSerに対してはラセマーゼ活性を示さないのに対し、アメフラシのAspラセマーゼはSerに対してもラセマーゼ活性を示す 19,20)。また、最近、下等生物で見出されるSerラセマーゼやマウス組換えSerラセマーゼが、種によって活性の強弱に差はあるもののAspラセマーゼ活性を示すことが報告された 28)。実際、著者らがヒト組換えSerラセマーゼを用いて解析したところ、マウス酵素と同様に比較的低レベルではあるが、Serに対してだけでなくAspに対するラセマーゼ活性も認められた(未発表データ)。また、Serラセマーゼのノックアウトマウスを用いた解析結果では、D-Ser含量のみならず、幾つかの脳組織におけるD-Asp含量も有意に低下している 29)。したがって、詳細は未だ不明であるが、D-Aspの生合成はD-Ser代謝に密接に関与していると考えられる。
冒頭でも述べたように、D-Aspは哺乳類体内に見出されたのがD-Serよりも早かったにもかかわらず、その研究は著しく遅れている。D-Aspの標的タンパク質が同定されていないことに加え、合成経路が解明されていないことが主な原因であると思われる。著者らは最近、哺乳類におけるD-Asp合成酵素の同定を念頭に置き、Aspラセマーゼ活性の簡便かつ高感度な測定法を開発した 30)。また、微生物由来の天然有機化合物や既存薬を材料にしたスクリーニングに基づき、D-Asp合成経路に抑制的に作用する2種の化合物(mithramycin Aおよびgeldanamy-cin)を同定した 31)。これらの測定法ならびに化合物は、未だ不明な点が多い哺乳類におけるD-Asp合成経路の解明に貢献すると思われる。
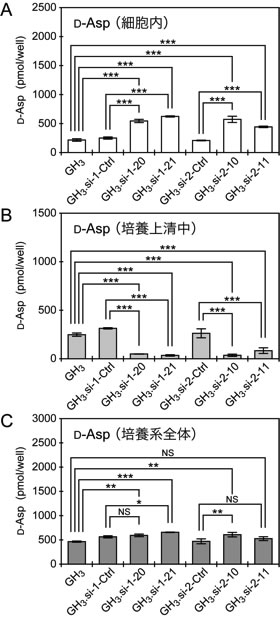
図1 Got1l1遺伝子のノックダウンがGH3細胞におけるD-Aspの生合成に与える影響
野生型GH3細胞、Got1l1遺伝子を標的とするsiRNAを発現させたGH3細胞(GH3.si-1-20、GH3.si-1-21、GH3.si-2-10、およびGH3.si-2-11)、および標的配列をランダムに入れ替えたsiRNAを発現させたGH3細胞(GH3.si-1-CtrlおよびGH3.si-2-Ctrl)における細胞内(A)、培養上清中(B)、および培養系全体(C)のD-Asp含量を示した(平均値 ± 標準偏差、n = 3)。*P < 0.05、**P < 0.01、***P < 0.001(Tukey–Kramer多重比較検定法)。NS:not significant(P > 0.05)。文献24) より改変。詳しくは本文および文献24) 参照。
前項で述べたように、哺乳類におけるD-Aspの合成経路は未だ解明されていないが、D-Aspを分解するDDOは古くから知られていた。DDOは生体内酸化酵素であり、1949年にStillらがウサギの腎臓および肝臓の抽出液にDDO活性を認めたのが最初の報告である 32)。DDOはD-Aspだけでなく、NMDAやD-Gluといった酸性D-アミノ酸を特異的に分解する 33,34)。また、D-Serなどの中性および塩基性D-アミノ酸を分解する別の生体内酸化酵素としてD-アミノ酸オキシダーゼ(D-amino acid oxidase;DAO)が知られている。両酵素ともに立体特異的であり、L-アミノ酸には作用しない。DDOおよびDAOはフラビンアデニンジヌクレオチド(flavin ade-nine dinucleotide;FAD)を補酵素とするフラビンタンパク質であり、1分子のDDOまたはDAOに1分子のFADが非共有結合で結合する。両酵素の触媒の機構は類似しており、D-アミノ酸の酸化的脱アミノ化によりイミノ酸と過酸化水素を生成する(図2)。哺乳類では、DDOおよびDAOは脳、腎臓および肝臓に多く存在し、細胞内ではペルオキシソームに局在する。両酵素は、内在性D-アミノ酸の代謝のみならず、食餌や腸内細菌に由来する外来性のD-アミノ酸の分解・除去を担っていると考えられている。
近年、脳内D-AspまたはD-Ser濃度の減少が、NMDA受容体の機能不全を引き起こし、その結果として統合失調症や躁うつ病が発症するという仮設が提唱されている。そこで、脳内D-AspまたはD-Ser濃度を上昇させるDDOおよびDAO阻害剤に、NMDA受容体の機能低下に関連した精神疾患の新規改善薬としての期待が寄せられている。実際、DDOのノックアウトマウスやDAO活性を欠損したマウスでは、脳内D-AspまたはD-Ser含量の上昇に伴い、NMDA受容体のアンタゴニスト投与時に観察される統合失調症様症状やうつ様症状の緩和が認められる 33–38)。したがって、脳内D-AspまたはD-Ser含量の上昇が期待されるDDOおよびDAO阻害剤は、NMDA受容体に関連した精神疾患に対する新規改善薬としての可能性を持つと考えられる。
図2 DDOおよびDAOによるD-アミノ酸の代謝
DDOおよびDAOはD-アミノ酸を酸化的に脱アミノ化し、イミノ酸と過酸化水素が生成する反応を触媒する。生成したイミノ酸は、非酵素的に2-オキソ酸とアンモニアに加水分解される。
表2 ヒト、マウスおよびラット組換えDDOおよびヒト組換えDAOに対する各化合物の阻害活性
化合物 |
IC50(mM) |
||||
ヒトDDO |
マウスDDO |
ラットDDO |
ヒトDAO |
||
マロン酸 |
|
879 ± 147 |
2875 ± 314 |
8486 ± 650 |
> 10000 |
安息香酸 |
|
> 10000 |
> 10000 |
ND |
134 ± 40 |
5-Aminonicotinic acid |
|
21.9 ± 5.6 |
20.5 ± 1.7 |
32.0 ± 3.3 |
> 2500 |
7-Hydroxy-4-hydro- 1,2,4-triazolo[4,3-a]pyrimidine- 6-carboxylic acid |
|
87.1 ± 16.0 |
76.8 ± 6.8 |
358 ± 43 |
> 500 |
5-Aminonicotinic acidおよび7-hydroxy-4-hydro-1,2,4-triazolo[4,3-a]pyrimidine-6-carboxylic acidのDDOに対する阻害様式を二重逆数プロットで解析したところ、これらの化合物はいずれも活性中心指向性の競合阻害剤としてDDOに作用することが明らかになった 43)。次に、これらの化合物の細胞内で発現するDDOに対する阻害効果を検討するために、ヒト子宮頸部がん由来のHeLa細胞にヒトDDOを高発現させた安定形質転換細胞株(HeLa.HA-hDDO-16)と、その対照として薬剤耐性能のみ獲得させたHeLa細胞(HeLa/NEO)を樹立した。興味深いことに、HeLa細胞では培養に伴って細胞内および培養上清中のD-Asp含量が増加する 24)。HeLa細胞の培養中にはD-Aspを添加していないので、この細胞はD-Aspを生合成していると考えられる。実際、高速液体クロマトグラフィーを用いた分析法で定量すると、HeLa/NEOの細胞内にはL-AspとともにD-Aspが検出される(図3)。また、HeLa.HA-hDDO-16の細胞内にもD-Aspが検出されるが、その量はHeLa/NEOと比較して著しく低レベルである。すなわち、HeLa. HA-hDDO-16の細胞内では高レベルで発現するDDOによってD-Aspが効率良く分解されると考えられる。そこで、上記2種の化合物とマロン酸のそれぞれをHeLa/NEOおよびHeLa.HA-hDDO-16に与え、一定時間後に細胞内のD-Asp量とL-Asp量を定量した。HeLa/ NEOにおいては、いずれの化合物を添加した場合にも細胞内D-AspおよびL-Asp含量に有意な変化は認められなかった(図3)。これとは対照的に、HeLa. HA-hDDO-16においては、5-aminonicotinic acidを与えた場合にのみ細胞内D-Asp含量の有意な上昇が認められた(図3A)。一方、細胞内L-Asp含量に有意な変化は認められなかった(図3B)。以上の結果から、5-aminonicotinic acidは細胞膜を通過してペルオキシソームに局在するDDOに到達し、DDOに対する阻害活性を効果的に発揮すると考えられる。
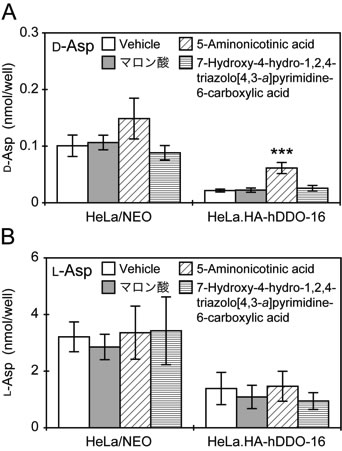
図3 DDO阻害剤の細胞内D-Asp含量に与える効果
ヒトDDOを高発現させた哺乳類培養細胞株(HeLa.HA-hDDO-16)を用いて、DDO阻害剤の細胞内で発現するDDOに対する阻害効果を解析した。阻害剤の添加後、細胞内のD-Asp(A)およびL-Asp(B)量を定量した。アスタリスクは溶媒のみ添加した細胞におけるD-Asp含量(Vehicle)と比較して有意差があることを示す(***P < 0.001;Dunnett多重比較検定法)。文献43) より改変。詳しくは本文および文献43) 参照。
DDO阻害剤はNMDA受容体の機能低下に関連した精神疾患に対する新規改善薬として期待されるので、本稿で紹介した化合物は臨床応用可能な新規改善薬を開発するためのリード化合物として有用であると考えられる。また、これらの化合物はDDOの構造機能相関、特に活性中心構造を解析するための活性中心プローブとしても有用であると思われる。今後、多因子疾患であるために世界的にも未だ十分な成果が得られていない統合失調症の治療分野の進展に、DDO阻害剤が新たな側面から貢献することが期待される。
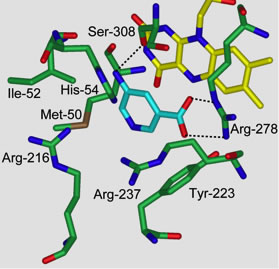
図4 ヒトDDOと5-aminonicotinic acidの複合体モデル
5-Aminonicotinic acid、FAD、およびアミノ酸残基それぞれのC原子はシアン、黄、および緑で示した。N原子、O原子、およびS原子はそれぞれ青、赤、およびカーキで示した。黒の点線は水素結合を示す。文献43) より改変。詳しくは本文および文献43) 参照。
本稿で紹介した著者らの研究成果は、北里大学薬学部生体分子解析学教室の皆様、ならびに北里大学薬学部創薬物理化学教室および北里大学薬学部微生物薬品製造学教室の先生方の協力の元に得られたものである。
1) Dunlop DS, Neidle A, McHale D et al. 1986. The presence of free D-aspartic acid in rodents and man. Biochem. Biophys. Res. Commun. 26: 27–32.
2) Fagg GE, Matus A. 1984. Selective association of N-methyl aspartate and quisqualate types of L-glutamate receptor with brain postsynaptic densi-ties. Proc. Natl. Acad. Sci. U. S. A. 81: 6876–6880.
3) Olverman HJ, Jones AW, Mewett KN et al. 1988. Structure/activity relations of N-methyl-D-aspartate receptor ligands as studied by their inhi-bition of [3H]D-2-amino-5-phosphonopentanoic acid binding in rat brain membranes. Neurosci-ence 26: 17–31.
4) Errico F, Napolitano F, Nisticò R et al. 2012. New insights on the role of free D-aspartate in the mammalian brain. Amino Acids 43: 1861–1871.
5) Katane M, Furuchi T, Sekine M et al. 2007. Mo-lecular cloning of a cDNA encoding mouse D-aspartate oxidase and functional characterization of its recombinant proteins by site-directed muta-genesis. Amino Acids 32: 39–78.
6) Katane M, Hanai T, Furuchi T et al. 2008. Hyper-active mutants of mouse D-aspartate oxidase: mu-tagenesis of the active site residue serine 308. Amino Acids 35: 75–82.
7) Katane M, Saitoh Y, Seida Y et al. 2010. Compar-ative characterization of three D-aspartate oxidases and one D-amino acid oxidase from Chaenorhab-ditis elegans. Chem. Biodivers. 7: 1424–1434.
8) Katane M, Saitoh Y, Maeda K et al. 2011. Role of the active site residues arginine-216 and arginine-237 in the substrate specificity of mammalian D-aspartate oxidase. Amino Acids 40: 467–476.
9) Katane M, Sekine M, Homma H. 2012. Assay of amino acid racemases. Methods Mol. Biol. 794: 367–379.
10) Katane M, Kawata T, Nakayama K et al. 2015. Characterization of the enzymatic and structural properties of human D-aspartate oxidase and com-parison with those of the rat and mouse enzymes. Biol. Pharm. Bull. 38: 298–305.
11) Koyama H, Sekine M, Furuchi T et al. 2005. A novel L-glutamate transporter inhibitor reveals en-dogenous D-aspartate homeostasis in rat pheo-chromocytoma MPT1 cells. Life Sci. 76: 2933–2944.
12) Koyama H, Adachi M, Sekine M et al. 2006. Cytoplasmic localization and efflux of endoge-nous D-aspartate in pheochromocytoma 12 cells. Arch. Biochem. Biophys. 446: 131–139.
13) Furuchi T, Suzuki T, Sekine M et al. 2009. Apoptotic inducers activate the release of D-aspartate through a hypotonic stimulus-triggered mechanism in PC12 cells. Arch. Biochem. Bio-phys. 490: 118–128.
14) 本間 浩. 2008. 哺乳類体内の遊離型D-アスパラギン酸の振舞いと機能. 生化学 80: 277–286.
15) 片根真澄, 本間 浩. 2010. 遊離型D-アミノ酸の役割. バイオインダストリー 27: 21–27.
16) Katane M, Homma H. 2011. D-Aspartate—an important bioactive substance in mammals: a re-view from an analytical and biological point of view. J. Chromatogr. B 879: 3108–3121.
17) Okada H, Yohda M, Giga-Hama Y et al. 1991. Distribution and purification of aspartate racemase in lactic acid bacteria. Biochim. Biophys. Acta 1078: 377–382.
18) Long Z, Lee J-A, Okamoto T et al. 2001. Occur-rence of D-amino acids and a pyridoxal 5’-phosphate-dependent aspartate racemase in the ac-idothermophilic archaeon, Thermoplasma aci-dophilum. Biochem. Biophys. Res. Commun. 281: 317–321.
19) Shibata K, Watanabe T, Yoshikawa H et al. 2003. Purification and characterization of aspar-tate racemase from the bivalve mollusk Scapharca broughtonii. Comp. Biochem. Physiol. B 134: 307–314.
20) Wang L, Ota N, Romanova EV et al. 2011. A novel pyridoxal 5’-phosphate-dependent amino acid racemase in the Aplysia californica central nervous system. J. Biol. Chem. 286: 13765–13774.
21) Long Z, Homma H, Lee J-A et al. 1998. Biosyn-thesis of D-aspartate in mammalian cells. FEBS Lett. 434: 231–235.
22) Long Z, Lee J-A, Okamoto T et al. 2000. D-Aspartate in a prolactin-secreting clonal strain of rat pituitary tumor cells (GH3). Biochem. Biophys. Res. Commun. 276: 1143–1147.
23) Long Z, Sekine M, Adachi M et al. 2002. Cell density inversely regulates D- and L-aspartate lev-els in rat pheochromocytoma MPT1 cells. Arch. Biochem. Biophys. 404: 92–97.
24) Matsuda S, Katane M, Maeda K et al. 2015. Bio-synthesis of D-aspartate in mammals: the rat and human homologs of mouse aspartate racemase are not responsible for the biosynthesis of D-aspartate. Amino Acids 47: 975–985.
25) Wolosker H, D’Aniello A, Snyder SH. 2000. D-Aspartate disposition in neuronal and endocrine tissues: ontogeny, biosynthesis and release. Neu-roscience 100: 183–189.
26) Kim PM, Duan X, Huang AS et al. 2010. Aspar-tate racemase, generating neuronal D-aspartate, regulates adult neurogenesis. Proc. Natl. Acad. Sci. U. S. A. 107: 3175–3179.
27) Tanaka-Hayashi A, Hayashi S, Inoue R et al. 2015. Is D-aspartate produced by glutamic-oxaloacetic transaminase-1 like 1 (Got1l1): a puta-tive aspartate racemase? Amino Acids 47: 79–86.
28) Uda K, Abe K, Dehara Y et al. 2015. Distribu-tion and evolution of the serine/aspartate racemase family in invertebrates. Amino Acids, in press, doi: 10.1007/s00726-015-2092-0.
29) Horio M, Ishima T, Fujita Y et al. 2013. De-creased levels of free D-aspartic acid in the fore-brain of serine racemase (<i>Srr</i>) knock-out mice. Neurochem. Int. 62: 843–847.
30) Katane M, Nakayama K, Kawata T et al. 2015. A sensitive assay for measuring aspartate-specific amino acid racemase activity. J. Pharm. Biomed. Anal. 116: 109–115.
31) Katane M, Kaneko Y, Watanabe M et al. 2016. Identification and characterization of natural mi-crobial products that alter the free D-aspartate con-tent of mammalian cells. Bioorg. Med. Chem. Lett. 26: 556–560.
32) Still JL, Buell MV, Knox WE et al. 1949. Studies on the cyclophorase system; D-aspartate oxidase. J. Biol. Chem. 179: 831–837.
33) 片根真澄, 本間 浩. 2009. D-アスパラギン酸とD-アスパラギン酸オキシダーゼノックアウトマウス. アニテックス 21: 5–11.
34) Katane M, Homma H. 2010. D-Aspartate oxi-dase: the sole catabolic enzyme acting on free D-aspartate in mammals. Chem. Biodivers. 7: 1435–1449.
35) Hashimoto A, Yoshikawa M, Niwa A et al. 2005. Mice lacking D-amino acid oxidase activity dis-play marked attenuation of stereotypy and ataxia induced by MK-801. Brain Res. 1033: 210–215.
36) Almond SL, Fradley RL, Armstrong EJ et al. 2006. Behavioral and biochemical characterization of a mutant mouse strain lacking D-amino acid ox-idase activity and its implication for schizophre-nia. Mol. Cell. Neurosci. 32: 324–334.
37) Weil ZM, Huang AS, Beigneux A et al. 2006. Behavioural alterations in male mice lacking the gene for D-aspartate oxidase. Behav. Brain Res. 171: 295–302.
38) Errico F, Rossi S, Napolitano F et al. 2008. D-Aspartate prevents corticostriatal long-term de-pression and attenuates schizophrenia-like symp-toms induced by amphetamine and MK-801. J. Neurosci. 28: 10404–10414.
39) Katane M, Saitoh Y, Hanai T et al. 2010. Thio-lactomycin inhibits D-aspartate oxidase: a novel approach to probing the active site environment. Biochimie 92: 1371–1378.
40) Katane M, Matsuda S, Saitoh Y et al. 2013. The antiviral drug acyclovir is a slow-binding inhibitor of D-amino acid oxidase. Biochemistry 51: 5665–5674.
41) Katane M, Osaka N, Matsuda S et al. 2013. Iden-tification of novel D-amino acid oxidase inhibitors by <i>in silico</i> screening and their functional charac-terization <i>in vitro</i>. J. Med. Chem. 56: 1894–1907.
42) 片根真澄, 本間 浩. 2014. ビタミンB2誘導体を補酵素とする脳内活性D-アミノ酸代謝酵素の新規阻害剤. ビタミン 88: 469–477.
43) Katane M, Yamada S, Kawaguchi G et al. 2015. Identification of novel D-aspartate oxidase inhibi-tors by <i>in silico</i> screening and their functional and structural characterization in vitro. J. Med. Chem. 58: 7328–7340.

片根 真澄(かたね ますみ)氏
略 歴
1994–1998 筑波大学第二学群生物学類
1998–2000 筑波大学大学院修士課程バイオシステム研究科
2000–2004 筑波大学大学院博士過程生物科学研究科 博士(生物科学)
2004–2007 北里大学薬学部 助手
2007–2012 北里大学薬学部 助教
2012–現在 北里大学薬学部 講師