結合型D-アミノ酸が引き起こす水晶体構成蛋白質の機能変化
髙田 匠
従来から、我々の体を構成するタンパク質はL-アミノ酸のみで構成され、生命体が生きている間に変化することはないと考えられてきた。しかし近年、加齢に応じて発症する白内障、アルツハイマー病、動脈硬化症など加齢性疾患組織内のタンパク質凝集部位にタンパク質結合型D-アミノ酸(主としてD-Asp)が発見されてきた(1-4)。これら生体内タンパク質結合型のD-Asp形成は加齢に応じた非酵素的な異性化反応の結果である。すなわち、生体内において代謝速度が非常に遅い器官、例えば眼の水晶体などでは体温程度の温度で時間とともにタンパク質中のAsp残基が化学的に異性化し、タンパク質の構造変化と組織の機能低下を引き起こす。また、これらの異性化率はある程度、アミノ酸配列及びタンパク質の立体構造に依存することが報告されている(5, 6)。以上のようなタンパク質結合型のD-Aspは、生体内において器官の機能存続期間と相関する分子時計とみなされており、迅速に定量することのできる分析法と、異性化Aspが誘起する詳細なタンパク質の構造と機能変化の解明が待たれる。
現在までに様々な生体内結合型D-Asp解析法が報告されているが、それらの包括的な一斉解析法は目的タンパク質内に多数存在する全Asp残基から、目的とするD-Asp一残基の同定と、その分析を行うには長時間を要する。さらに、これらタンパク質中での結合型D-Asp形成は組織の機能低下や疾病の原因と関連すると考えられているが、実際に形成した結合型D-Aspがそのタンパク質の生化学的性質や機能にどのような影響を及ぼすのかに関して直接的な検証を行った報告はほとんどない。そこで、著者らは、 ヒト高齢者の眼の水晶体をモデル組織とし、その主要構成タンパク質であるクリスタリン中での結合型D-Aspを網羅的に検知する分析手法の開発を行いながら、結合型D-Asp形成が実際に水晶体機能に及ぼす影響について検討してきた。それらの概要と結果を以下の実験1-3として紹介する。
我々のグループは、これまで、水晶体主要構成タンパク質、αA-クリスタリン中の部分配列中、
Asp残基部位をD-β-Aspに置換し、本配列を3回繰り返したリピートペプチドを抗原として作成したD-β-Asp含有タンパク質認識抗体を用いて生体内での結合型D-β-Asp含有タンパク質の網羅的解析を進めてきた。しかしながら、ポリクローナル抗体による検出は簡便ではあるが、定性的であり、さらに、D-β-Asp含有タンパク質の同定作業及び各異性化部位の同定作業を行うためにはタンパク質の同定、ペプチドマッピング、ペプチド水解物の異性体分析という煩雑な作業を行わなければならないという欠点があった(7-10)。しかし近年、高速液体クロマトグラフィー(HPLC)と質量分析装置(MS/MS)を用いることでこれらの欠点を補いつつ、さらに高感度でタンパク質中Asp異性体を同定する手法が藤井らにより報告された(図1)(11)。この手法ではアミノ酸配列情報を必須とするものの、配列情報が既知であるタンパク質に関しては該当タンパク質中の結合型D-β-Asp部位を高感度に同定することができる。
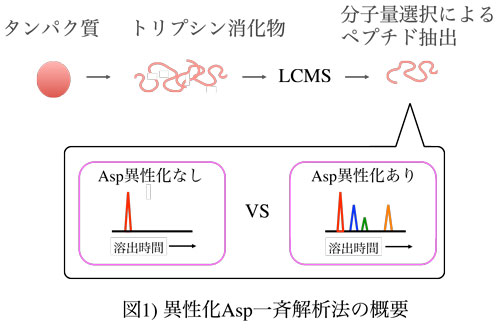
本手法はマイクログラムレベルの試料中、フェムトモルレベルのタンパク質中のAsp異性体を見出すことを可能にした。
しかしながら、最終的に4種に分離するAsp異性体(L-α-Asp、L-β-Asp、D-α-Asp、D-β-Asp)含有ペプチドを、それぞれ同定するために各Asp異性体を含む合成コントロールペプチドを用いた確認実験を必要とする。そこで、生体内結合型D-β-Asp網羅的解析においてボトルネックとなるこのステップを省略するため、我々は、加齢組織中のタンパク質をトリプシン消化後、質量分析装置に導入する直前、さらに3種の各Asp異性体認識酵素で処理することでタンパク質中のAsp異性化部位を、より迅速に分析する方法を開発した(12)(図2)。
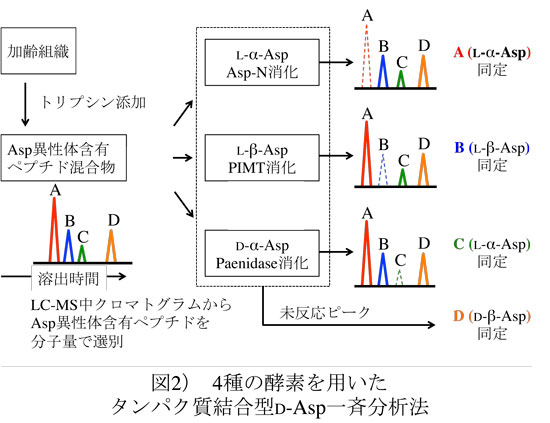
従来の煩雑な実験ステップを省略できる本手法ではLC-MSと市販酵素のみを用いることで、精度良くD-Asp異性化率を定量することが可能であることから、D-Asp含有タンパク質を、より簡便な加齢疾患マーカーとして用いることが可能になった。
本手法を加齢後の水晶体の一斉解析に用いて得られた結果を表1に示す(12)。一度の解析で加齢後組織(水晶体)中、複数のタンパク質中混合物中から多数の異性化Asp部位とその異性化率を同定することが可能であった。
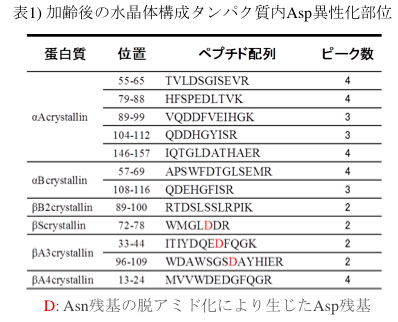
水晶体を構成するタンパク質は主として、α-、β-、γ-クリスタリンである。各単量体の分子量はおよそ2万であり、α-クリスタリンは通常40量体、β-クリスタリンは2-10量体の会合体状態を取るいっぽうで、γ-クリスタリンは単量体として存在する。各年代の水晶体中クリスタリンをゲル濾過によってサイズ別に分離後(図3)、それぞれのクリスタリン画分をLC-MS/MSで分析したところ、本来ヘテロ会合体であるはずのαA-, αB-クリスタリンがγ-クリスタリン画分に単量体として混在していることが明らかになった(13, 14)。これらは、ゲル濾過結果を観察しただけでは判断不可能であるが、微量試料中のAsp異性化率解析を長所とする前述手法に用いることで評価が可能であった。
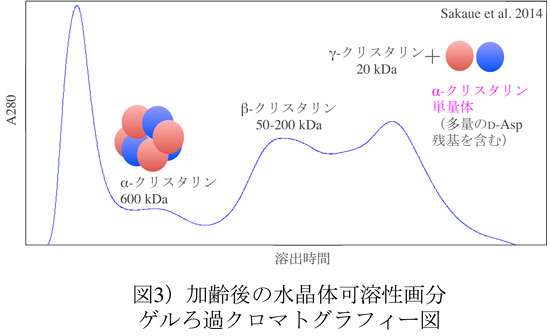
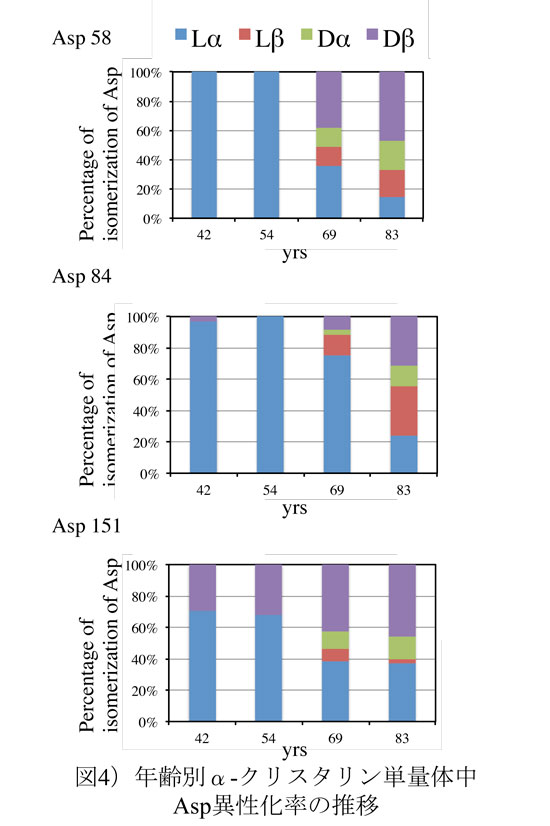
実際に分析、評価したところ、これらα-クリスタリン単量体中に見出された異性化Aspの割合は加齢に応じて増加しており、さらに、その異性化率が水晶体不溶性画分のものと酷似していることが明らかとなった(14)(図4)。
以上のように、α-クリスタリン中にD-Aspが形成されると会合体形成能が失われ、α-クリスタリンが不溶化することが示唆された。しかし、これまでα-クリスタリンの立体構造が未知なため、これらのAspの異性化部位と構造との相関性は確認されてはいない。
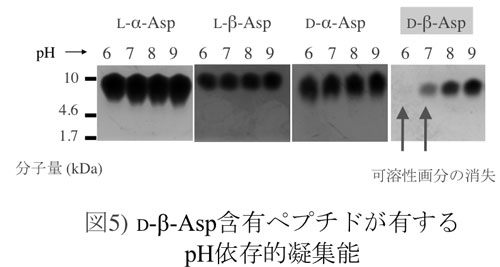
α-クリスタリンは巨大な会合体状態を維持しつつ、その分子シャペロン機能を発揮することで長期間、水晶体の透明性維持に寄与する。上述したようにα-クリスタリンを構成するαA-, αB-サブユニット中のD-Asp形成と、それに伴うα-クリスタリンサブユニット乖離や不溶化との相関性が示唆されたが、D-Aspを挿入したタンパク質を人為的に作成することは技術的に困難なため、そのようなサンプルを作出し、その機能を調べるという直接的な証明には至っていない。そこで、本研究では上記実験においてαB-クリスタリン単量体中に見られた96番目の異性化Asp残基に着目し、類似配列(KLKVLGDVIEV; 以下αB-P)中のAsp残基を4種のAsp異性体(L-α-Asp、L-β-Asp、D-α-Asp、D-β-Asp)に置き換え、化学合成したペプチドを作成し、結合型D-Asp形成がポリペプチド構造や機能に与える影響を検討した。その結果、D-β-Asp含有αB-PのみがpH依存的に凝集することが明かとなった(図5)。
また興味深いことに、本ペプチドのみが若年齢ヒトより抽出、精製したα-クリスタリンに対する凝集誘導能を有することが明らかになった(図6)。以上の結果はα-クリスタリン中でのD-Asp形成がα-クリスタリンの分子シャペロン機能を低下させ、白内障発症の一因となる可能性を示した。

生体内のD-アミノ酸は遊離型(生体内、又は食品など)、ペプチド型(薬品など)を問わず知られておりライフサイエンスの一部として捉えられている(15-19)。しかしタンパク質結合型D-アミノ酸が担う生化学的機能に関する詳細な報告は少ない。これらは微量成分であるD-アミノ酸の化学的、物理的性質がL-アミノ酸と同一であるが故に分析法が限られること、タンパク質中へのD-アミノ酸導入法が存在しないことに起因する。つまり、アミノ酸光学異性体分析の困難さが、多分野の研究者にとってD-アミノ酸研究参画に対する障壁となっていた。我々のグループは加齢後の組織内(水晶体内)における結合型D-アミノ酸のスクリーニング手法の開発と、形成されたD-Aspが誘起するタンパク質の機能低下及び加齢性疾患(白内障など)発症との関連性を明らかにしてきた。おそらく、生体内タンパク質中でのAsp異性化はタンパク質内Asp 残基周囲の構造が比較的緩い部位において生じ易い。そしてAsp異性化の結果、誘起されるポリペプチド主鎖伸長や側鎖反転がタンパク質表面又は内部の荷電状態、局所的構造変化などを引き起こし、局所的な相互作用変化を経て加齢後組織の機能を低下させると考えている。
我々が開発、改良を進めている結合型Asp異性体一斉同定法は、様々なタンパク質会合体に対して応用可能であり、他の分離方法と組み合わせることで、より多様な試料に応用することが可能である。様々な分野にわたる研究者がD-アミノ酸研究に参画し、D-アミノ酸研究が、益々隆盛をきわめること、また、加齢性疾患治療分野での大きな進歩に寄与することを心より期待している。
本稿で紹介した研究成果は、京都大学原子炉実験所・放射線生命科学研究部門・放射線機能生化学研究分野の皆様の協力の下に得られたものである。
1) Fisher GH, Garcia NM, Payan IL, Cadilla-Perezrios R, Sheremata WA, Man EH. D-aspartic acid in purified myelin and myelin basic protein. Biochem Biophys Res Commun. 1986;135(2):683-7.
2) Masters PM, Bada JL, Zigler JS, Jr. Aspartic acid racemisation in the human lens during ageing and in cataract formation. Nature. 1977;268(5615):71-3.
3) Powell JT, Vine N, Crossman M. On the accumulation of D-aspartate in elastin and other proteins of the ageing aorta. Atherosclerosis. 1992;97(2-3):201-8.
4) Roher AE, Lowenson JD, Clarke S, Wolkow C, Wang R, Cotter RJ, et al. Structural alterations in the peptide backbone of beta-amyloid core protein may account for its deposition and stability in Alzheimer's disease. J Biol Chem. 1993;268(5):3072-83.
5) Fujii N, Harada K, Momose Y, Ishii N, Akaboshi M. D-amino acid formation induced by a chiral field within a human lens protein during aging. Biochem Biophys Res Commun. 1999;263(2):322-6.
6) Fujii N, Kawaguchi T, Sasaki H, Fujii N. Simultaneous stereoinversion and isomerization at the Asp-4 residue in betaB2-crystallin from the aged human eye lenses. Biochemistry. 2011;50(40):8628-35.
7) Aki K, Fujii N, Saito T, Fujii N. Characterization of an antibody that recognizes peptides containing D-beta-aspartyl residues. Mol Vis. 2012;18:996-1003.
8) Takata T, Shimo-Oka T, Kojima M, Miki K, Fujii N. Differential analysis of D-beta-Asp-containing proteins found in normal and infrared irradiated rabbit lens. Biochem Biophys Res Commun. 2006;344(1):263-71.
9) Takata T, Shimo-Oka T, Miki K, Fujii N. Characterization of new D-beta-aspartate-containing proteins in a lens-derived cell line. Biochem Biophys Res Commun. 2005;334(4):1022-31.
10) Yang D, Fujii N, Takata T, Shimo-Oka T, Tajima S, Tanaka Y, et al. Immunological detection of D-beta-aspartate-containing protein in lens-derived cell lines. Mol Vis. 2003;9:200-4.
11) Fujii N, Sakaue H, Sasaki H, Fujii N. A rapid,comprehensive liquid chromatography-mass spectrometry (LC-MS)-based survey of the Asp isomers in crystallins from human cataract lenses. J Biol Chem. 2012;287(47):39992-40002.
12) Maeda H, Takata T, Fujii N, Sakaue H, Nirasawa S, Takahashi S, et al. Rapid survey of four Asp isomers in disease-related proteins by LC-MS combined with commercial enzymes. Anal Chem. 2015;87(1):561-8.
13) Sakaue H, Takata T, Fujii N, Sasaki H, Fujii N. Alpha B- and betaA3-crystallins containing d-aspartic acids exist in a monomeric state. Biochim Biophys Acta. 2015;1854(1):1-9.
14) Takata T, Fujii N. Isomerization of Asp residues plays an important role in alphaA-crystallin dissociation. FEBS J. 2015.
15) Heck SD, Siok CJ, Krapcho KJ, Kelbaugh PR, Thadeio PF, Welch MJ, et al. Functional consequences of posttranslational isomerization of Ser46 in a calcium channel toxin. Science. 1994;266(5187):1065-8.
16) Kato S, Ishihara T, Hemmi H, Kobayashi H, Yoshimura T. Alterations in D-amino acid concentrations and microbial community structures during the fermentation of red and white wines. J Biosci Bioeng. 2011;111(1):104-8.
17) Montecucchi PC, de Castiglione R, Piani S, Gozzini L, Erspamer V. Amino acid composition and sequence of dermorphin, a novel opiate-like peptide from the skin of Phyllomedusa sauvagei. Int J Pept Protein Res. 1981;17(3):275-83.
18) Nagata Y, Homma H, Lee JA, Imai K. D-Aspartate stimulation of testosterone synthesis in rat Leydig cells. FEBS Lett. 1999;444(2-3):160-4.
19) Oliet SH, Mothet JP. Regulation of N-methyl-D-aspartate receptors by astrocytic D-serine. Neuroscience. 2009;158(1):275-83.

髙田 匠(たかた たくみ)氏
略 歴
1997-2001 立命館大学理工学部 応用化学
2001-2003 京都大学大学院理学研究科
化学専攻修士課程
2003-2006 京都大学大学院理学研究科
化学専攻博士課程
2006-2009 オレゴン健康科学大学
博士研究員
2009-2013 マサチューセッツ工科大学
博士研究員
2013-2015 京都大学原子炉実験所
放射線生命科学部門 博士研究員
2015-現在 東京薬科大学 助教